3º BIMESTRE FUNÇÕES ORGÂNICAS OXIGENADAS


Os grupos
funcionais oxigenados estão presentes numa infinidade de compostos de
grande importância biológica, como por exemplo: nos açúcares,
no amido dos cereais, nos óleos dos vegetais
e na gordura dos animais. Presente também nas bebidas alcoólicas, essências,
perfumes, plásticos, fibras têxteis sintéticas, produtos de
limpeza e produtos para automóveis (álcool, glicerina
e etilenoglicol).
NOMENCLATURA
(GRUPO MENOR) + (GRUPO MAIOR)
2º BIMESTRE REAÇÕES DE OXIRREDUÇÃO
As funções
oxigenadas são compostos ternários de Carbono,
Hidrogênio e Oxigênio. Entre elas estão os álcoois,
enóis, fenóis, aldeídos, cetonas, ácidos carboxílicos, éteres e derivados
dos ácidos carboxílicos. Elas representam uma família
enorme e muito diversificada de compostos orgânicos. Isto acontece porque,
depois do Carbono e do Hidrogênio, o Oxigênio é o elemento
químico de maior presença nos compostos orgânicos.
ÁLCOOIS (R–OH)
São
compostos orgânicos com o grupo funcional –OH (hidroxila ou
oxidrila) ligado a carbono saturado (possui apenas ligações
simples).
Os álcoois estão
presentes nas bebidas alcoólicas, como combustível
para automóveis, como solvente na produção de loções, gel,
perfumes e desodorantes, nas limpezas domésticas. Fazem
parte também dos álcoois, a glicerina presente
em sabões, cosméticos, aditivos alimentares (panetone), usada
nos pneus de carros, o etilenoglicol usado
como aditivo para carros (anticongelante de radiadores),
os açúcares, como sacarose, glicose, frutose, lactose,
maltose, o amido presente na batata, milho,
trigo, a celulose (papel), nos óleos e
gorduras.
CLASSIFICAÇÃO
DOS ÁLCOOIS
-
QUANTO AO NÚMERO DE HIDROXILAS:
- Monoálcool ou
monol: possui
apenas 1 OH;
- Diálcool ou
diol: possui 2
OH;
- Triálcool ou
triol: possui 3
OH.
Os
álcoois apresentam normalmente um grupo OH (hidroxila)
por carbono.
-
QUANTO AO TIPO DE CARBONO:
- Álcool
primário: ligado
a carbono primário;
- Álcool
secundário: ligado
a carbono secundário;
- Álcool
terciário: ligado
a carbono terciário.
NOMENCLATURA
PREFIXO + INFIXO + OL
metanol
propan-2-ol
4-metil-pentan-2-ol
3,3-dimetil-butan-1-ol
3-metil-ciclo-hexan-1-ol
butano-1,3-diol
3-metil-but-3-en-1-ol
ENÓIS (R–OH)
São
compostos orgânicos com o grupo funcional –OH (hidroxila ou
oxidrila) ligado a carbono insaturado (possui ligação
dupla). Os enóis são muito instáveis, ou seja, não
existem isolados e sim em uma mistura com um aldeído (equilíbrio
aldo-enólico) ou com uma cetona (equilíbrio ceto-enólico).
FENÓIS OU HIDROXIBENZENOS (Ar–OH)
São
compostos orgânicos com o grupo funcional –OH (hidroxila ou
oxidrila) ligado a anel aromático.
Os Fenóis são
usados na fabricação de plásticos, corantes, perfumes, explosivos,
desinfetantes como a creolina (solução aquosa,
alcalina, da mistura de cresóis) e o lisol (emulsão de cresóis
em sabão). Na natureza existem também vários compostos que apresentam
o grupo –OH, característicos dos fenóis como
o eugenol (essência de cravo da índia, usado como anti séptico
bucal), a vanilina (essência de baunilha, usada na fabricação
de doces e sorvetes) e o timol (essência de tomilho).
CLASSIFICAÇÃO
DOS FENÓIS
-
QUANTO AO NÚMERO DE HIDROXILAS:
- Monofenol: possui apenas 1 OH;
- Difenol: possui 2 OH;
- Trifenol: possui 3 OH.
NOMENCLATURA
RAMIFICAÇÃO + BENZENOL (oficial)
benzenol (fenol ou hidroxi-benzeno)
3-metil-benzenol (3-metil-fenol ou
3-metil-hidroxi-benzeno)
benzeno-1,2-diol (2-hidroxi-fenol ou
1,2-dihidroxi-benzeno)
benzeno-1,2,4-triol (2,4-dihidroxi-fenol ou
1,2,4-trihidroxi-benzeno)
ALDEÍDOS (R–CHO ou
Ar–CHO)
São
compostos orgânicos com o grupo funcional aldoxila ou formila ligado a carbono primário de cadeia
aberta, alicíclica ou anel aromático.
ligado a carbono primário de cadeia
aberta, alicíclica ou anel aromático.
 ligado a carbono primário de cadeia
aberta, alicíclica ou anel aromático.
ligado a carbono primário de cadeia
aberta, alicíclica ou anel aromático.
Os aldeídos estão
presentes na emissão dos poluentes dos automóveis à álcool e
quando o organismo metaboliza o álcool; no formol para
conservação de tecidos e cadáveres; nos odores característicos
da amêndoa, da canela e do limão.
NOMENCLATURA
PREFIXO + INFIXO + AL
metanal
etanal
3-metil-butanal
CETONAS (R–CO–R1 , Ar–CO–Ar1 ou R–CO–Ar)
São
compostos orgânicos com o grupo funcional carbonila
ligado a carbono secundário de cadeia aberta, alicíclica ou anel aromático.

ligado a carbono secundário de cadeia aberta, alicíclica ou anel aromático.
As cetonas estão
presentes na acetona e aparece também em compostos
naturais, como essências e perfumes, extraídos de vegetais e
animais como a essência de jasmim.
NOMENCLATURA
PREFIXO + INFIXO + ONA
ÁCIDOS CARBOXÍLICOS (R–COOH ou
Ar–COOH)
ligado a carbono primário de cadeia
aberta, alicíclica ou anel aromático.
Os ácidos carboxílicos estão presentes no vinagre,
no veneno das formigas e em diversos tipos de odores como
o cheiro de manteiga rançosa, queijo roquefort, cheiro característico
dos animais, cheiro do suor e sebo das pessoas.
NOMENCLATURA
ÁCIDO + PREFIXO + INFIXO + OICO
ácido etanoico
ácido 3-metil-butanoico
OUTRAS FORMAS DE NOMENCLATURAS PARA
ÁCIDOS CARBOXÍLICOS, ALDEÍDOS, ÁLCOOIS E CETONAS
Para os ácidos carboxílicos e aldeídos utilizam-se os
seguintes prefixos referentes a 1, 2 3 e 4 carbonos.
1 Carbono - form
2 Carbonos - acet
3 Carbonos - propion
4 Carbonos
- butir
ÁCIDOS
CARBOXÍLICOS
ÁCIDO + PREFIXO + ICO
ácido fórmico (presente no veneno
das formigas)
ácido acético (responsável pelo
aroma e sabor do vinagre)
ácido propiônico (presente na gordura
de animais)
ácido butírico (odor da manteiga
rançosa)
ALDEÍDOS
PREFIXO + ALDEÍDO
formaldeído (formol)
acetaldeído
propionaldeído
butiraldeído
ÁLCOOIS
ÁLCOOL + GRUPO ORGÂNICO
(metil, etil) + ICO
CETONAS
CETONA + GRUPO ORGÂNICO
(metil, etil) + ICA + e + GRUPO ORGÂNICO
(metil, etil) + ICA
(os grupos devem aparecer em ordem alfabética e
se os grupos forem iguais, escreve o nome do grupo uma
só vez, antecedido pelo prefixo di)
ÉTERES (R–O–R1, Ar–O–Ar1 ou R–O–Ar)
São compostos orgânicos de cadeia heterogênea (heteroátomo) com
o grupo funcional
ligado a cadeia aberta, alicíclica ou anel benzênico.
O éter comum era utilizado antigamente como anestésico,
atualmente é empregado como solvente apolar na extração
de óleos, gorduras, essências e perfumes de fontes vegetais ou animais.
(GRUPO MENOR) + (GRUPO MAIOR)
(PREFIXO + OXI)
+
(PREFIXO + INFIXO + O)
metoxi-etano (éter metílico e
etílico)
1-metoxi-propano (éter metílico e
propílico)
ÉSTERES (R–COO–R1, Ar–COO–Ar1 ou R–COO–Ar)
Obtido pela reação de esterificação entre ácidos
carboxílicos e álcoois.
Os ésteres são substâncias usadas como flavorizantes (sabor
+ aroma) como o aroma de laranja, abacaxi, morango, damasco, etc.
também é usado como solventes em esmaltes de unhas.
PREFIXO + INFIXO + OATO + DE + GRUPO ORGÂNICO + A
etanoato de isobutila
butanoato de butila
_________________________________________________________________________
O que significa a palavra oxidar?
ELETROQUÍMICA
O que é a corrente elétrica que circula em um fio metálico?
Hoje sabemos que é um fluxo (movimento ordenado) de cargas elétricas que transitam pelo fio e que esse fluxo pode realizar certo trabalho, como acender uma lâmpada, movimentar um motor, etc.
Como se produz corrente elétrica?
Há dois processos principais:
1º BIMESTRE EQUILÍBRIO QUÍMICO
Somente o ferro que se oxida?
Existem várias mudanças em que se ocorre uma oxidação como por exemplo:
- Produção do vinagre;
- Combustão do gás metano;
- Processo da fotossíntese;
- Metabolismo da glicose.
O Nox (número de oxidação) de um elemento químico pode ser definido como a carga que
um átomo teria se ambos os elétrons, em cada ligação, fossem considerados
pertencentes ao elemento mais
eletronegativo.
Existem 3 tipos de espécies químicas:
- Substância simples (Cl2);
- Substância composta (HClO3);
- Íons (Cl1-, CO32-).
Substância simples: nox =
0.
Substância composta:
- Metais alcalinos (família 1A) e Ag: nox = +1;
- Metais alcalinos terrosos (família 2A) e Zn:
nox = +2;
- Al:
nox = +3;
- S: nox = -2
(compostos binários, com S à direita);
- Família
7A: nox = -1 (compostos
binários, com elemento à direita);
- H:
nox = +1 (não metais) e nox
= -1 (metais);
- O: nox = -2 (óxidos), nox
= -1 (peróxidos), nox = -1/2 (superóxidos) e nox = +1 ou +2 (ligado ao F).
Íons simples: nox = carga do próprio íon.
OBSERVAÇÕES:
- A soma dos nox de uma substância composta é igual a zero;
- A soma dos nox de um íon composto é igual a carga do íon;
- Nox mínimo: é a carga que o elemento necessita para atingir o octeto;
- Nox máximo: é a carga que o elemento adquire quando perde todos os elétrons da última camada. O nox máximo coincide com o n.° do grupo.
Reações de oxirredução são
reações que ocorrem com transferência de elétrons.
Oxidação: doa
elétrons (aumenta o nox);
Redução: recebe elétrons (reduz o
nox);
Agente oxidante (sofre redução): é a espécie química presente nos reagentes que age causando a oxidação de algum elemento;
Agente redutor (sofre oxidação): é a espécie química presente nos reagentes que age causando a redução de algum elemento.
ELETROQUÍMICA
O que é a corrente elétrica que circula em um fio metálico?
Hoje sabemos que é um fluxo (movimento ordenado) de cargas elétricas que transitam pelo fio e que esse fluxo pode realizar certo trabalho, como acender uma lâmpada, movimentar um motor, etc.
Como se produz corrente elétrica?
Há dois processos principais:
- pelos geradores elétricos, que transformam energia mecânica em energia elétrica;
- pelas pilhas e baterias, que transformam energia química em energia elétrica.
A
matéria é constituída de partículas eletricamente carregadas; assim, não é
surpreendente que seja possível converter a energia química em energia elétrica
e vice-versa. O estudo desses processos de interconversão é uma parte
importante da físico-química, denominada eletroquímica, que tem por objetivo em grande parte, o
estudo da relação entre a energia elétrica e a transformação química.
A eletroquímica é baseada em dois processos de
transformação:
- reações de substâncias (reações de oxirredução) capazes de “gerar” energia elétrica (pilhas, acumuladores, baterias);
- uso da energia elétrica para transformar as substâncias (eletrólise).
Existem
várias aplicações práticas da eletroquímica, como:
- As
pilhas são largamente utilizadas em rádios, gravadores, calculadoras,
brinquedos e equipamentos;
- Acumuladores
e baterias são muito empregados na indústria automobilística;
- A eletrólise nos permite obter uma série de produtos industriais importantes,
como: produtos químicos de alta pureza para pesquisas, produtos de laboratório
químico para análises e matéria-prima para fabricação de outros produtos de
maior complexidade.
CELAS GALVÂNICAS (PILHAS E BATERIAS)
PILHA DE DANIELL
Uma cela galvânica ou pilha é um dispositivo que permite a interconversão de energia química em elétrica.
A pilha de Daniell foi construída pelo cientista inglês John Daniell em 1836.
FORÇA ELETROMOTRIZ (fem) OU DIFERENÇA DE POTENCIAL (ddp - ΔE°)
Toda reação que envolve transferência de elétrons, apresenta uma força eletromotriz (fem) ou diferença de potencial (ddp ou ΔE°). Para cada semirreação existe um potencial baseado no potencial de referência que é dado para a semirreação do hidrogênio (E° = 0 V).A tabela de potencial-padrão de eletrodo (em volts) foi construída considerando uma solução de concentração 1 mol/L à 25°C e 1 atm de pressão.
PILHA DE DANIELL
Uma cela galvânica ou pilha é um dispositivo que permite a interconversão de energia química em elétrica.
A pilha de Daniell foi construída pelo cientista inglês John Daniell em 1836.
Oxidação: Zn0
à Zn2+(aq) + 2e-
Redução: Cu2+(aq)
+ 2e- à Cu0
Reação
global: Zn0 + Cu2+(aq) à
Zn2+(aq) + Cu0FORÇA ELETROMOTRIZ (fem) OU DIFERENÇA DE POTENCIAL (ddp - ΔE°)
Toda reação que envolve transferência de elétrons, apresenta uma força eletromotriz (fem) ou diferença de potencial (ddp ou ΔE°). Para cada semirreação existe um potencial baseado no potencial de referência que é dado para a semirreação do hidrogênio (E° = 0 V).A tabela de potencial-padrão de eletrodo (em volts) foi construída considerando uma solução de concentração 1 mol/L à 25°C e 1 atm de pressão.
DE° = E°red. (maior) – E°red. (menor)
Para a pilha de Daniell:
E°red. (Zn) = - 0,76 V
E°red. (Cu) = + 0,34 V
ΔE°
= E°red.(maior) – E°red.(menor)
ΔE°
= 0,34 – (- 0,76)
ΔE°
= 0,34 + 0,76
ΔE°
= 1,10 V
ΔE° > 0 (reação espontânea - pilhas e baterias).
ΔE° < 0 (reação não espontânea - eletrólise).
________________________________________________________________________
Muitas reações ocorrem completamente, ou seja, até que pelo menos um dos reagentes seja totalmente consumido. Um exemplo desse tipo de reação é a que acontece quando queimamos um palito de fósforo.
Existem sistemas, no entanto, em que as reações direta e inversa ocorrem simultaneamente. Esses sistemas são denominados reversíveis e acontece tanto em processos químicos como em processos físicos.
Um exemplo de processo reversível é o que ocorre com a água líquida contida num frasco fechado. Nesse sistema, temos moléculas de água passando continuamente do estado líquido para o de vapor e do de vapor para o líquido.
PRINCIPAIS CARACTERÍSTICAS DE UMA REAÇÃO EM EQUILÍBRIO QUÍMICO
- Um equilíbrio químico é atingido quando a velocidade da reação direta se iguala com a velocidade da reação inversa;

- No equilíbrio químico as concentrações dos reagentes e produtos se mantem constantes;

- O equilíbrio químico é macroscopicamente estático, ou seja, ao atingir o equilíbrio visualmente é como se a reação parasse de acontecer;
- O equilíbrio químico é microscopicamente dinâmico, ou seja, ao atingir o equilíbrio a reação continua acontecendo, porém com velocidade e concentração constantes.
Imagine uma experiência em que 1,00 mol de CO e 1,00 mol de NO2 fossem colocados em um recipiente fechado, de 1 litro de capacidade, e mantido à temperatura constante de 600 °C. Nesse instante inicial da experiência, teríamos [CO] = 1,00 mol/L, [NO2] = 1,00 mol/L e ainda não teríamos CO2 nem NO.
Iniciada a reação, imagine que, com o passar do tempo, fossem obtidos os dados da tabela abaixo, na qual os valores indicados são as concentrações em mol/L de cada substância em cada instante mencionado (note que os valores da tabela seguem a estequiometria da reação):
Veja que, dos 40 min aos 60 min, as concentrações não mudam — dando a entender que, a partir desse ponto, a reação atingiu o equilíbrio químico e as concentrações dos reagentes e dos produtos permanecerão inalteradas (constantes).
EQUILÍBRIOS HOMOGÊNEOS E HETEROGÊNEOS
Equilíbrio homogêneo: reagentes e produtos estão em uma mesma fase, formando um sistema homogêneo.
Equilíbrio heterogêneo: reagentes e produtos estão em mais de uma fase, formando um sistema heterogêneo.
CONSTANTE DE EQUILÍBRIO EM FUNÇÃO DAS CONCENTRAÇÕES (Kc ou Ke)
A constante de equilíbrio (Kc ou Ke) varia somente com alteração da temperatura.
ESPONTANEIDADE DE UMA REAÇÃO
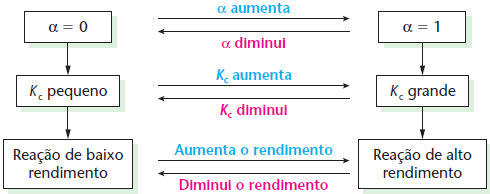
Uma reação é tanto mais favorecida (mais espontânea), ou seja, tende a formar maior quantidade de produto a uma certa temperatura quanto maior for o valor da sua constante de equilíbrio nessa temperatura.
- Kc > 1, a concentração dos produtos é maior que a concentração dos reagentes, indicando que a reação direta prevalece sobre a reação inversa;
- Kc < 1, a concentração dos reagentes é maior que a concentração dos produtos, indicando que a reação inversa prevalece sobre a reação direta;
GRAU DE EQUILÍBRIO
Essa porcentagem nos dá a ideia de quanto a reação caminhou, ou seja, qual foi a extensão (ou rendimento) da reação. Fazendo-se uma analogia com um trecho que percorremos numa estrada, temos:
CONSTANTE DE EQUILÍBRIO EM FUNÇÃO DAS PRESSÕES PARCIAIS (Kp)
Na expressão de equilíbrio em função das pressões parciais (Kp) somente entram as substâncias gasosas. Assim como no Kc o Kp varia somente com alteração da temperatura.
DESLOCAMENTO DE EQUILÍBRIO (PRINCÍPIO DE LE CHATELIER)
Deslocamento de equilíbrio é toda e qualquer alteração da velocidade da reação direta ou da reação inversa,
provocando modificações
nas concentrações das
substâncias e levando o sistema a um novo estado de equilíbrio. Quando um fator externo (perturbação) age
sobre um sistema em equilíbrio, este se desloca, procurando minimizar a ação do fator aplicado (lei ou princípio de Le Chatelier). Resumidamente, podemos dizer que o sistema é contra aquele fator externo aplicado sobre aquele sistema em equilíbrio. Os fatores externos que podem deslocar
um equilíbrio químico são:
- Alteração das concentrações de um ou mais participantes do equilíbrio;
- Alteração da pressão total sobre o sistema;
- Alteração da temperatura do sistema.
EFEITO DA CONCENTRAÇÃO
- adicionando qualquer participante, o equilíbrio se desloca no sentido de consumi-lo (tendendo a minimizar o efeito da adição);
- retirando qualquer participante, o equilíbrio se desloca no sentido de recolocá-lo (tendendo a minimizar o efeito da retirada).
EFEITO DA PRESSÃO
- o aumento da pressão total desloca o equilíbrio no sentido de menor volume, pois a redução no volume minimiza o efeito da pressão aplicada;
- a redução da pressão total desloca o equilíbrio no sentido de maior volume, pois o aumento de volume minimiza a redução da pressão.
EFEITO DA TEMPERATURA
A temperatura, além de provocar deslocamento do equilíbrio, é o único fator responsável por alterações na constante de equilíbrio Kc ou Kp.
- aumento da temperatura desloca o equilíbrio no sentido da reação endotérmica, ou seja, ΔH > 0 (absorve calor).
- diminuição da temperatura desloca o equilíbrio no sentido da reação exotérmica, ou seja, ΔH < 0 (libera calor).
EQUILÍBRIO QUÍMICO EM SOLUÇÕES DE ELETRÓLITOS (ÁCIDOS E BASES)
Soluções aquosas de ácidos e bases também são encontradas na situação de equilíbrio. Como acontece em qualquer equilíbrio, aqui também serão definidos um grau de equilíbrio (α) e uma constante de equilíbrio (Ka, no caso dos ácidos ou ainda Kb, no caso das bases).
LEI DA DILUIÇÃO DE OSTWALD
No final do século XIX, Friedrich Wilhelm Ostwald, químico de origem russo-germânica, deduziu pela primeira vez uma expressão matemática relacionando a constante de ionização (Ka, ou Kb), a concentração em mol/L (M) e o grau de ionização (a) para monoácidos e monobases.



































































































Nenhum comentário:
Postar um comentário