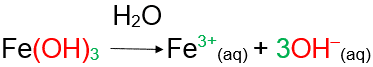3º BIMESTRE QUANTIDADES E MEDIDAS
É
possível pesar os átomos e as moléculas?
Para
pesar ou medir alguma coisa torna-se necessário:
- Escolher um padrão;
- Usar uma unidade compatível
com a grandeza a ser medida.
Qual
a unidade conveniente para pesar átomos e moléculas?
1u
= 1 de 12C (u = unidade de massa
atômica)
12
1u
= 1,66 . 10-24 g = 0,00000000000000000000000166 g
Nº
de massa (A): É a soma do nº
de prótons e nº de nêutrons existentes no núcleo de
um átomo.
Ex: Ac =
6p + 6n = 12 (sem unidade)
Massa
atômica (MA): é a massa
de um único átomo expressa em u. Indica
quantas vezes determinado átomo é mais pesado que 1 de 12C.
12
As massas
atômicas são os valores indicados nas Tabelas Periódicas e
são calculados pela média ponderada das massas atômicas de
todos os isótopos existentes para aquele elemento
químico.
Ex: MAK = 39 u
MAPb = 207 u
MANe = 20 u
Massa
molecular (MM): É a massa
de uma única molécula expressa em u. A massa
molecular é a soma das massas atômicas de todos os átomos que
compõe a fórmula química de uma substância iônica,
molecular, metálica ou de um íon composto.
Ex: MM(CO2)= MAC + 2xMAO MM(O2)= 2xMAO
12 + 2x16 2x16 44u 18u
É
possível pesar um único átomo ou molécula ?
1 átomo de Fe = 56 u
n átomos de Fe = 56 g
n partículas (átomos,
moléculas) = 1 mol = 6,0 . 1023 partículas (constante
de Avogadro)
6,0
. 1023 = 600000000000000000000000 (seiscentos sextilhões)
Mol: é a quantidade de
matéria que contém n partículas quanto forem os átomos
contidos em 0,012 kg (12 g) de 12C.
- 1 mol de moléculas = 6,0 .
1023 moléculas;
- 1 mol de átomos = 6,0 .
1023 átomos;
- 1 mol de íons = 6,0 .
1023 íons;
- 1 mol de elétrons = 6,0 . 1023 elétrons.
Massa
molar (M): É a massa, em gramas, de 1 mol de partículas
(6,0 . 1023 partículas).
MK = 39 g/mol MPb = 207 g/mol MNe = 20 g/mol
1 mol = 39 g 1 mol = 207 g 1 mol = 20 g
n
= m , sendo n
= quantidade de matéria em mol.
M
m = massa da substância em g.
M = massa molar em g/mol.
2º BIMESTRE SAIS
Sal é toda substância iônica que, em solução aquosa sofre dissociação iônica, liberando pelo menos um ânion diferente de OH- e pelo menos um cátion diferente de H+. Segundo Arrhenius sal é um composto resultante da neutralização de um ácido por uma base, com eliminação de água (reação de neutralização). É formado por um cátion proveniente de uma base e um ânion proveniente de um ácido.
PROPRIEDADES DOS SAIS
PROPRIEDADES DOS SAIS
- São substâncias iônicas;
- Formam soluções aquosas condutoras de eletricidade (dissociação iônica);
- Tem sabor salgado;
- Formados pela reação de neutralização entre ácidos e bases
- Quanto ao nº de elementos:
Binário: a molécula contém 2 elementos.
Ex: Na2S, KCl
Ternário: a molécula contém 3 elementos.
Ex: NaNO3, K2CO3
Quaternário: a molécula contém 4 elementos.
Ex: NH4ClO3, NaOCN
- Quanto a presença de oxigênio:
Oxigenado ou oxissais: sal que contém o elemento oxigênio.
Ex: KNO3, Na2SO4
Não oxigenado ou halóides: sal que não contém o elemento oxigênio.
Ex: NaCl, NH4Br
- Quanto a presença de água no retículo cristalino:
Hidratado: apresenta moléculas de água intercaladas. É chamado de água de cristalização ou água de hidratação.
Ex: CaCl2.2 H2O, CuSO4.5 H2O
Anidro: não apresenta moléculas de água intercaladas.
Ex: CaCl2, CuSO4
- Quanto a natureza dos íons:
Normal ou neutro: sal que não apresenta hidrogênios ionizáveis e nem íons hidroxila (neutralização total).
Ex: NaCl, KNO3, CaCO3
Duplo ou misto: sal que apresenta dois cátions diferentes que não sejam hidrogênios ionizáveis, ou dois ânions diferentes que não sejam hidroxilas (neutralização total).
Hidrogenossal ou sal ácido: sal que apresenta hidrogênio ionizável (neutralização parcial).
Hidroxissal ou sal básico: sal que apresenta íons hidroxila (neutralização parcial).
NOMENCLATURA DOS SAIS
NOME DO ÂNION + DE + NOME DO CÁTION
Quando o cátion possuir mais de um NOX, usa-se números em algarismos romanos indicando o número de oxidação ou os sufixos oso (menor Nox) e ico (maior Nox).
SOLUBILIDADE DOS SAIS
Os sais são solúveis ou insolúveis de acordo com os cátions e ânions que os formam:
OBSERVAÇÕES:
- Quando se diz que um sal é insolúvel, na verdade se quer dizer que sua solubilidade em água é muito pequena, pois nenhuma substância é totalmente insolúvel;
- Existem alguns sais que são considerados como parcialmente solúveis;
- Todos os sais de metais alcalinos e amônio (NH4+) são solúveis;
- Os sais insolúveis sofrem pequena dissociação iônica, por isso originam soluções com pequena quantidade de íons, sendo considerados maus eletrólitos.
São compostos
binários (dois elementos) oxigenados, onde o oxigênio tem Nox
= -2
e é o
elemento
mais eletronegativo. Todos os elementos formam óxidos com exceção
do flúor (fluoretos
de oxigênio) que é mais eletronegativo que o oxigênio.
CLASSIFICAÇÃO DOS ÓXIDOS
- Quanto ao tipo de ligação química:
Óxidos
moleculares: Formados por não
metais e oxigênio (ligação covalente).
Ex:SO3,
CO2, Sb2O3.
Óxidos
iônicos: Formados
por metais e oxigênio (ligação iônica).
Ex:Na2O,CaO, Fe2O3.
NOMENCLATURA DOS ÓXIDOS
- Óxidos moleculares
prefixo
de quantidade do oxigênio +
óxido + de
+ prefixo
de quantidade do não metal +
nome do não metal
- Óxidos iônicos
óxido + de
+ nome
do metal (nox
fixo)
(nox
variado)
óxido + de
+ nome
do metal + nº
nox
óxido + nome
do metal + ico
(nox
maior)
oso
(nox
menor)
CLASSIFICAÇÃO DOS ÓXIDOS
- Quanto as propriedades:
Óxidos
ácidos ou anidridos: Formados por não
metais ou
metais de transição (Nox alto: +5, +6 ou +7) e oxigênio.
Ex: SO3,
CO2,
CrO3,Mn2O7.
-
geralmente compostos moleculares,
gasosos
e
com baixos PF e PE;
-
geralmente solúveis em
água;
- reagem com água produzindo
ácido;
- reagem com bases
produzindo sal e água;
- chamados de anidridos por
serem formados através de ácidos com
eliminação de água.
Óxidos
básicos: Formados
por metais
alcalinos e
alcalinoterrosos e alguns
metais de transição (Nox baixo: +1 ou +2, exceto Zn, Sn e Pb) e oxigênio;
Ex:Na2O,CaO, FeO.
- compostos iônicos,
sólidos e com
elevados PF e PE;
- geralmente pouco
solúveis em água, com
exceção dos
óxidos dos metais alcalinos e alcalinoterrosos;
- reagem com água produzindo
uma base;
- reagem com ácidos
produzindo
sal e água.
Óxidos
neutros: formados
por não
metais e oxigênio. Só
existem quatro.
Ex: CO,
NO, N2O
e
H2O.
- não reagem com
água, ácidos ou bases, ou
seja, não
apresentam caráter ácido ou básico;
- compostos moleculares
e
gasosos
(exceto a água).
Óxidos
anfóteros: Formados por semimetais
ou
metais
de transição (Nox médio: +3 ou +4, ou +2 (Zn, Sn e Pb)) e oxigênio.
Ex: Sb2O3,
Al2O3, PbO2, ZnO, SnO, PbO.
-
possuem caráter intermediário
entre
os óxidos
ácidos e
básicos;
-
reagem apenas
com
ácidos ou
bases fortes produzindo
sal e
água;
-
Geralmente compostos iônicos,
sólidos
e
com elevados
PF e
PE;
- Geralmente
insolúveis em
água.
Óxidos duplos,
mistos ou salinos: formados por metais
de transição (Nox: +8/3) e oxigênio.
(E3O4)
Ex: Fe3O4
(magnetita),
Pb3O4
(zarcão).
- formados por dois
óxidos do
mesmo elemento químico;
FeO e Fe2O3, PbO
e Pb2O3.
- Geralmente compostos iônicos
e
sólidos.
Peróxidos(O2)2-:
formados
por metais
alcalinos ou alcalinoterrosos e oxigênio (Nox:
-1).
Ex: H2O2,
Na2O2, CaO2.
- compostos iônicos
e
sólidos, exceto
o H2O2 (líquido
e molecular);
- solúveis em água;
- reagem com água produzindo base
e H2O2;
BaO2
+ 2H2O →
Ba(OH)2
+
H2O2
- reagem com ácidos
produzindo sal e H2O2.
BaO2
+ H2SO4
→ BaSO4↓
+ H2O2
Superóxidos
ou
polióxidos
(O4)2-:
formados
por metais
alcalinos ou alcalinoterrosos e oxigênio
(Nox: -1/2).
Ex: Na2O4, CaO4.
- compostos iônicos
e
sólidos;
- solúveis em
água;
- reagem com água produzindo
base, H2O2 e O2;
BaO4
+ 2H2O →
Ba(OH)2
+
H2O2
+ O2
- reagem com ácidos
produzindo sal,
H2O2 e O2.
BaO4
+
H2SO4
→ BaSO4↓
+ H2O2
+ O2
NOMENCLATURA DE PERÓXIDOS E SUPERÓXIDOS
peróxido + de
+ nome
do metal (1A ou 2A)
superóxido + de
+ nome
do metal (1A ou 2A)
TEORIA DA DISSOLUÇÃO ELETROLÍTICA
No final do século XIX (1884), o cientista sueco Arrhenius realizou numerosas experiências relacionadas com a passagem de corrente elétrica através de soluções aquosas e, com base nessas experiências, chegou à definição da Teoria da dissolução eletrolítica.
De acordo com Arrhenius, determinadas substâncias, quando dissolvidas em água, são capazes de dar origem a íons positivos (cátions) e a íons negativos (ânions), conduzindo a eletricidade e outras substâncias não produzem íons e não conduzem a corrente elétrica.
As substâncias iônicas (ligação iônica), quando dissolvidas em água, produzem solução aquosa que conduz corrente elétrica. Algumas substâncias moleculares (ligação covalente), quando dissolvidas em água, produzem solução aquosa que não conduz corrente elétrica e outras substâncias moleculares, que conduz.
DISSOCIAÇÃO IÔNICA E IONIZAÇÃO
Nas substâncias iônicas que são formadas por um retículo cristalino, na presença de água seus íons são separados pelas moléculas de água, ficando livres na solução e conduzindo a corrente elétrica. Esse processo é chamado de dissociação iônica.
Algumas substâncias moleculares não conduzem a corrente elétrica na presença de água, porque estão sofrendo apenas uma dissolução.
Algumas substâncias moleculares, passam a conduzir a corrente elétrica na presença de água, devido à formação de íons pela interação entre as moléculas polares de ambos os compostos. Esse processo é chamado de ionização.
Solução iônica: é aquela que contém íons livres (dissociação iônica ou ionização).
Solução molecular: é aquela que não contém íons livres (não sofre dissociação iônica ou ionização).
Eletrólitos: são as substâncias que, dissolvidas em água, produzem solução condutora de corrente elétrica.
Solução eletrolítica: é aquela que conduz a corrente elétrica.
Solução não eletrolítica: é aquela que não conduz a corrente elétrica.
FUNÇÕES INORGÂNICAS
Por volta de 1807, o cientista sueco Berzelius fez
uma distinção dizendo que as substâncias obtidas dos seres vivos ou de
restos mortais eram “orgânicos” e substâncias provenientes do mundo
inanimado
(água, pedra, ar) seriam “inorgânicos”.
Surgiu-se então a “Química Orgânica” e a “Química
Inorgânica”.
Produzir um composto orgânico a partir de
um composto inorgânico era impossível, pois se acreditava que compostos
orgânicos eram produzidos exclusivamente por organismos vivos devido à necessidade de uma “força vital” para a sua formação.
Em 1828, o cientista alemão Wöhler
tentando sintetizar (produzir) uma substância inorgânica, o cianato de amônio (NH4OCN),
a partir de 2 outras substâncias inorgânicas, o cianato de potássio (KOCN)
e o sulfato
de amônio ( (NH4)2SO4), observou que ao aquecer o cianato de amônio havia
formação de cristais brancos que
era na verdade ureia (CO(NH2)2),
substância presente na urina dos mamíferos.
Em 1858, o cientista alemão Kekulé,
propôs que a química orgânica é a
parte da química que estuda praticamente todos os compostos
do elemento carbono e a química inorgânica é a
parte da química que estuda os compostos dos demais elementos químicos e
alguns poucos compostos do elemento carbono (compostos de transição), dentre
eles: CO2, CO,
carbonatos, cianatos, cianetos, grafite e diamante.
Função
Química: constitui
um grupo de substâncias químicas que, por apresentarem semelhanças
estruturais, são dotadas de propriedades
químicas semelhantes (propriedades funcionais). As funções
inorgânicas são: ácidos, bases (hidróxidos), sais e
óxidos.
ÁCIDOS
Ácido (teoria de Arrhenius - 1884): É
toda substância
molecular que,
em solução
aquosa se
ioniza,
originando
exclusivamente como cátion, íons
H+ (H3O+).
PROPRIEDADES DOS ÁCIDOS
- São substâncias moleculares (ligação covalente);
- Formam soluções aquosas condutoras de eletricidade (ionização);
- Tem sabor azedo;
- São corrosivos.
- Quanto à presença de oxigênio na molécula:
Ex.: HCl, HF.
Oxiácidos: São os ácidos cuja molécula
contém oxigênio.
Ex.: HClO4, H2SO3
- Quanto ao número de elementos na molécula:
Ex: HCl, H2S
Ternário: a molécula contém 3 elementos.
Ex: HNO3, H2SO4
Ex: HNO3, H2SO4
Quaternário: a molécula contém 4 elementos.
Ex: HCNO, HSCN
Ex: HCNO, HSCN
- Quanto ao número de hidrogênios ionizáveis:
Nos hidrácidos, todos os hidrogênios presentes nas moléculas são ionizáveis.
Nos oxiácidos, são ionizáveis somente os hidrogênios ligados a átomos de oxigênio.
Por isso existem duas exceções ao número de hidrogênios ionizáveis, o H3PO3 (diácido) e o H3PO2 (monoácido).
- Quanto à força:
A
força dos ácidos é medida pelo grau de ionização.
Ex: De cada 100 moléculas de HCl dissolvidas, 92 moléculas sofrem ionização:
Os hidrácidos mais conhecidos são assim classificados:
A força dos oxiácidos pode ser determinada pela diferença (x) entre o número de átomos de oxigênio e o número de átomos de hidrogênio ionizáveis.
O H2CO3, por ser um ácido instável, decompõe-se mais facilmente do que se ioniza, apresentando um pequeno grau de ionização. Assim, é considerado um ácido fraco, não seguindo a regra apresentada.
NOMENCLATURA DOS ÁCIDOS
- Hidrácidos:
+ ídrico
- Oxiácidos:
ácido + ânion - ito + oso
BASES OU HIDRÓXIDOS
Base (teoria de Arrhenius - 1884): É toda substância iônica que, em solução aquosa sofre dissociação iônica, originando exclusivamente como ânion, íons OH- (hidroxila ou oxidrila).
fórmula geral de uma base (X < 5)
PROPRIEDADES DAS BASES
- São substâncias iônicas (ligação iônica), exceto, a amônia que é molecular - NH3);
- Formam soluções aquosas condutoras de eletricidade (dissociação iônica);
- Tem sabor amargo e cáustico;
- São corrosivas.
- Quanto ao número de hidroxilas:

- Quanto à solubilidade:
O hidróxido de magnésio, Mg(OH)2 (família 2A), por apresentar solubilidade muito pequena, é considerada praticamente insolúvel.
A única base que não apresenta metal em sua fórmula (ligação covalente) é o hidróxido de amônio (NH4OH), que existe apenas em solução aquosa e, portanto, é uma base solúvel. O hidróxido de amônio pode ser obtido borbulhando-se gás amônia (NH3) em água, onde ocorre a ionização do gás.
- Quanto à força:
A força das bases pode ser relacionada com a sua solubilidade: quanto maior for a solubilidade de uma base, maior será o seu grau de dissociação e ela será considerada uma base forte. No entanto, se a base for pouco solúvel, o seu grau de dissociação será menor e ela será considerada fraca.
- Bases fortes: metais alcalinos (família 1A) e metais alcalino-terrosos (família 2A), exceto Mg(OH)2;
- Bases fracas: Mg(OH)2, NH4OH e o restante.
NOMENCLATURA DAS BASES
HIDRÓXIDO DE + NOME DO CÁTION
Quando o cátion
possuir mais
de um NOX,
usa-se números em algarismos
romanos indicando
o número
de oxidação ou os sufixos oso
(menor Nox)
e ico
(maior Nox).
HIDRÓXIDO DE + NOME DO CÁTION
INDICADORES ÁCIDO-BASE
O pH é o
símbolo para a grandeza físico-química “potencial
hidrogeniônico”. Essa grandeza indica a acidez,
neutralidade ou alcalinidade de
uma solução aquosa. O pH refere-se a uma medida que indica
se uma solução líquida é ácida (pH
< 7), neutra (pH = 7), ou
básica/alcalina (pH > 7). Uma
solução
neutra só
tem o valor de pH = 7 à 25 °C, o
que implica variações do valor medido conforme a temperatura.
O pH pode
ser determinado usando um medidor de pH (também
conhecido como pHmetro) que
consiste em um eletrodo acoplado a um potenciômetro. O pH pode
ser determinado indiretamente pela
adição
de um indicador de pH na solução em análise. A cor
do indicador varia conforme o pH da
solução. Indicadores comuns são a fenolftaleína, alaranjado de metila
e o azul
de bromofenol.
Existem também os indicadores naturais extraídos
de vegetais como: folha do repolho roxo, uva e
amora.
Os
indicadores são
substâncias que reagem de forma diferente com um ácido, e com uma base, ou
seja, há uma variação
de cor.
Fenolftaleína
Na presença de ácido: incolor
Na presença de base:
rosa
Tornassol
Na presença de ácido:
vermelho
Na presença de base:
azul